综研两会视点 | 何渊源:以满足临床需求为导向,加快医药转型升级步伐
时间:2018-03-12 11:28

何渊源
中国(深圳)综合开发研究院
公共经济研究所
医药卫生改革创新
是今年我国重大工作
医药卫生是关系亿万人民健康的重大民生问题。今年3月5日,李克强总理在2018年政府工作报告中,对我国医药卫生取得的成果进行了总结,并对未来政府在医药卫生工作提出了建议。过去5年,我国基本医保覆盖人数达到了13.5亿人,取消了长期实行的药品加成政策,全面推进医疗体系综合改革,医保制度不断完善,食品药品监管体系加快改革。2018年,我国将重点推进“医疗+互联网”和分诊医疗,加大对癌症等重大疾病的防治攻关,着力解决看病就医难的问题,引入多种资本进入医疗卫生领域,提高基本医保和大病保险保障水平,加快实现食品药品的全程追溯监管。
近年来,国家十分重视医药医疗器械产业的创新发展对人民健康的支撑作用,从《“十三五”国家战略性新兴产业发展规划》制定,到《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《创新意见》)的出台,极大地激发医药研发的活力,促进药品医疗器械产业结构调整和技术创新,对解决人民用药难、用药贵起到了积极作用。
药品医疗器械
审评审批制度改革升级版
2017年10月中办、国办印发的《创新意见》,是在药品医疗器械审评审批两年改革阶段性成果的基础上,进一步深化改革的重要举措,可以看作是2015年《关于改革药品医疗器械审评审批制度的意见》(即44号文)的升级版。《创新意见》一共包括了改革临床试验管理、加快上市审评审批、促进药品医疗器械创新和仿制药发展、加强药品医疗器械全生命周期管理、提升技术支撑能力、加强组织实施六个部分共36项改革措施,突出了以临床需求为导向,让老百姓用得上救命药、用得起放心药,将系统性推进我国药品医疗器械产业的转型升级。
加快新药研发,
让老百姓用得上救命药
我国新药审批审评速度一直难以满足技术和产业的发展,许多效果好、质量高的药品医疗器械由于我国审批审批速度较慢,迟迟不能进入我国市场,让病患者错失了治疗的机会。例如2016年,我国食品药品监督管理总局(CFDA)才刚刚批准了首个2价HPV宫颈癌疫苗上市许可,美国疾控中心当年就将2价、4价HPV宫颈癌疫苗从采购名单中剔除,国家免疫规计划中仅留有9价HPV宫颈癌疫苗,我国比美国整整迟了10年。虽然近年来我国新药审批审评速度取得了明显的进步,但是与国际先进水平还是有较大距离。
《创新意见》围绕公众用药需求,对临床急需药和罕见病用药,可附带条件批准上市,优化审评审批程序;在公共健康受到重大威胁的情况,实施专利强制许可药品优先审评审批制度。针对我国临床试验资源不足制约新药研发的情况,对临床试验机构审批从以前的资格认定制改为实行备案制,临床试验审批由过去的明示许可改为默示许可,接受符合要求的在境外多中心取得的临床试验数据,临床试验领域将迎来较快发展,支撑我国药品医疗器械的创新发展。同时,为了鼓励新药研发,通过完善医疗保险药品目录动态调整机制、药品专利链接、专利期补偿,以及临床试验数据保护等措施加强了创新权益保护。

提高仿制药质量,
让老百姓用得起放心药
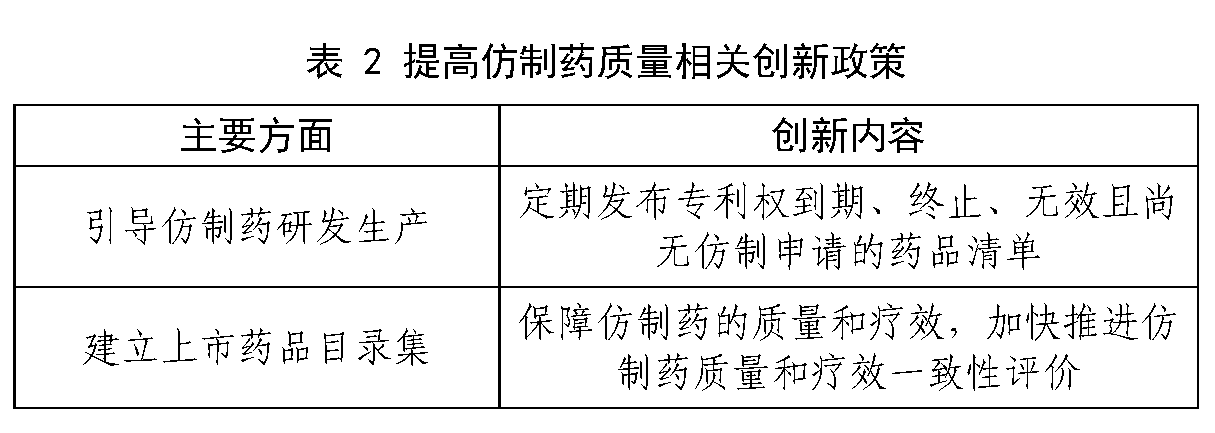
由于我国原研药研发能力较弱,很多疑难病症都只能通过进口药品或医疗器械进行治疗,但是由于进口药品的价格昂贵,近年来出现了很多去印度买仿制药的现象,严重扰乱了我国医药市场,也给病患者带来了安全隐患。让老百姓用得起的放心药,也是《创新意见》中体现的重要思想之一。《创新意见》提出定期发布专利权到期、终止、无效且尚无仿制申请的药品清单,引导仿制药研发生产,提高公众用药可及性。建立上市药品目录集,保障仿制药的质量和疗效,加快推进仿制药质量和疗效一致性评价。通过推动仿制药的发展,加快药品进口替代,未来原研药的专利到期后,工艺相对简单的仿制药项目可能会出现仿制生产厂家扎堆现象,从而出现原研药产品价格悬崖式下降的情况,达到解决百姓用药贵的效果。
加强监管能力,
深化审评审批制度改革
《创新意见》对监管体系也作出了一系列改革。首先是监管理念的变化,《创新意见》从以前强调事前认定改为事中、事后全生命周期监管,通过上市许可持有人制度、上市许可持有人直接报告不良反应和不良事件制度、药品医疗器械再评价制度、规范药品学术推广行为等措施,明确了每个环节的责任主体,更加科学的对整个产业链中的责任和风险进行了分配。其次是监管队伍的变化,《创新意见》提出了建立审评为主导、检查检验为支撑的技术审评体系,以及组建专业化的药品审评团队和医疗器械审评团队。最后是部门间合作的变化,着力解决了过往药品医疗器械科技、产业相关部门监管碎片化的问题,建立了药品医疗器械审评审批制度改革部际联席会议制度,加强了食药监局与发改、科技、工信、财政、人力资源、卫计委、知识产权、中医药管理局等部门间的沟通和联系。

医药医疗器械监管体制一直是我国大健康产业发展的短板,而且改革越深入遇到的深层次的矛盾越多。虽然《创新意见》中还有一些具体工作需要深入落实,如我国罕见病目录、上市药品目录集、药品专利链接制度、药品专利期限补偿制度的建立等,但是《创新意见》的出台体现了我国对深化药品医疗器械审评审批制度改革的决心和诚意,将推动药品特别是重大新药研发,促进医疗器械产业升级发展,改变我国创新药物、高端医疗器械长期依赖进口的局面,为公众提供满意的医疗保障体系。
医药卫生改革创新
是今年我国重大工作
医药卫生是关系亿万人民健康的重大民生问题。今年3月5日,李克强总理在2018年政府工作报告中,对我国医药卫生取得的成果进行了总结,并对未来政府在医药卫生工作提出了建议。过去5年,我国基本医保覆盖人数达到了13.5亿人,取消了长期实行的药品加成政策,全面推进医疗体系综合改革,医保制度不断完善,食品药品监管体系加快改革。2018年,我国将重点推进“医疗+互联网”和分诊医疗,加大对癌症等重大疾病的防治攻关,着力解决看病就医难的问题,引入多种资本进入医疗卫生领域,提高基本医保和大病保险保障水平,加快实现食品药品的全程追溯监管。
近年来,国家十分重视医药医疗器械产业的创新发展对人民健康的支撑作用,从《“十三五”国家战略性新兴产业发展规划》制定,到《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《创新意见》)的出台,极大地激发医药研发的活力,促进药品医疗器械产业结构调整和技术创新,对解决人民用药难、用药贵起到了积极作用。
药品医疗器械
审评审批制度改革升级版
2017年10月中办、国办印发的《创新意见》,是在药品医疗器械审评审批两年改革阶段性成果的基础上,进一步深化改革的重要举措,可以看作是2015年《关于改革药品医疗器械审评审批制度的意见》(即44号文)的升级版。《创新意见》一共包括了改革临床试验管理、加快上市审评审批、促进药品医疗器械创新和仿制药发展、加强药品医疗器械全生命周期管理、提升技术支撑能力、加强组织实施六个部分共36项改革措施,突出了以临床需求为导向,让老百姓用得上救命药、用得起放心药,将系统性推进我国药品医疗器械产业的转型升级。
加快新药研发,
让老百姓用得上救命药
我国新药审批审评速度一直难以满足技术和产业的发展,许多效果好、质量高的药品医疗器械由于我国审批审批速度较慢,迟迟不能进入我国市场,让病患者错失了治疗的机会。例如2016年,我国食品药品监督管理总局(CFDA)才刚刚批准了首个2价HPV宫颈癌疫苗上市许可,美国疾控中心当年就将2价、4价HPV宫颈癌疫苗从采购名单中剔除,国家免疫规计划中仅留有9价HPV宫颈癌疫苗,我国比美国整整迟了10年。虽然近年来我国新药审批审评速度取得了明显的进步,但是与国际先进水平还是有较大距离。
《创新意见》围绕公众用药需求,对临床急需药和罕见病用药,可附带条件批准上市,优化审评审批程序;在公共健康受到重大威胁的情况,实施专利强制许可药品优先审评审批制度。针对我国临床试验资源不足制约新药研发的情况,对临床试验机构审批从以前的资格认定制改为实行备案制,临床试验审批由过去的明示许可改为默示许可,接受符合要求的在境外多中心取得的临床试验数据,临床试验领域将迎来较快发展,支撑我国药品医疗器械的创新发展。同时,为了鼓励新药研发,通过完善医疗保险药品目录动态调整机制、药品专利链接、专利期补偿,以及临床试验数据保护等措施加强了创新权益保护。
(0)













